
清空記錄
歷史記錄
取消
清空記錄
歷史記錄



從靜脈到皮下:rHuPH20+組氨酸+蛋氨酸標配(下)
在單抗 - rHuPH20 皮下注射劑的配方設計中,甲硫氨酸(蛋氨酸)是不可或缺的 “穩定衛士”,目前所有市售該類制劑均添加了 5-10 mM 濃度的甲硫氨酸,其作為犧牲型抗氧化劑,正默默守護著蛋白質的結構與功能。
甲硫氨酸通常作為犧牲添加劑加入到配方中以保護蛋白免受氧化,目前市售產品的上限約為 10 mM (1.49mg/mL)[7]。蛋白質和肽類易受氧化損傷,這是由于某些氨基酸會與其環境中的氧自由基發生反應。氧化可能改變蛋白質的理化特性(如折疊和亞基結合),導致聚集或斷裂。此外,根據被氧化的氨基酸在蛋白質中的位置是否靠近其功能域或表位樣結構域,氧化還可能對藥效和免疫原性產生潛在的負面影響[8]。一項研究發現光氧化導致重組 IgG1 抗體Fc區域中兩個關鍵甲硫氨酸殘基(Met252和Met428)被氧化,進而破壞CH2域穩定性,引發共價聚集體的形成,并降低其與FcRn受體的結合活性及抗體依賴性細胞毒性(ADCC)功能。實驗表明,與其他添加的氨基酸或糖相比,添加甲硫氨酸是防止蛋白質制劑中光誘導氧化的最有效賦形劑(表2)[9]。另有一篇文章也討論了重組單克隆抗體HER2(rhuMAb HER2)在光照和高溫下的氧化問題,證明了添加甲硫氨酸可以通過清除自由基或氧來防止抗體中的甲硫氨酸被氧化(圖5,圖6)[10]。目前市場上單抗-rHuPH20皮下注射劑,其抗體絕大多數是 IgG1 亞型。重組IgG1抗體保守區的甲硫氨酸被氧化的風險可能隨著制劑濃度的增加而增加,因此高濃度制劑增加了對抗氧化劑的需求。
表2 尺寸排阻色譜(SEC)對光暴露mAb8樣品中聚集體(HMWS)和片段(LMWS)相對于其避光對照的定量分析。
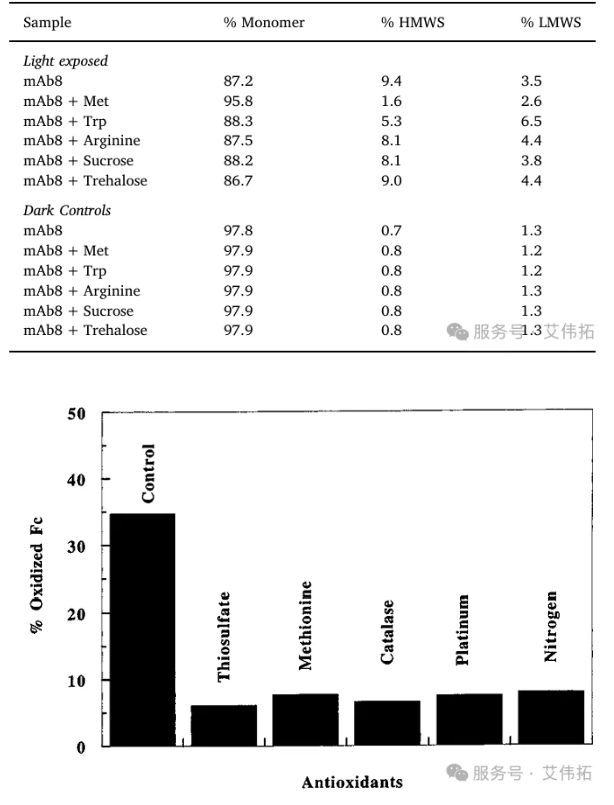
圖5 防止配方中 rhuMAb HER2 溫度誘導氧化的方法。將抗氧化劑添加到制劑中,在 40°C 下放置 2 周后,通過 HIC評估蛋氨酸氧化,通過疏水相互作用色譜(HIC)檢測rhuMAb HER2的蛋氨酸氧化水平,與在相同條件下儲存的不含抗氧化劑的對照樣品的結果進行比較。
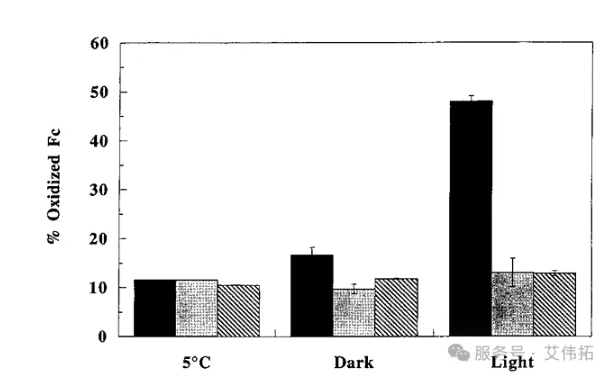
圖6抗氧化劑對 rhuMAb HER2 光誘導氧化的影響。將不含抗氧化劑的樣品(黑色)、含6.3 mM硫代硫酸鈉的樣品(灰色)及含3.5 mM蛋氨酸的樣品(條紋)分別進行包裹(暗處)與未包裹(光照)處理,置于光強20,000Lux的光照箱中27°C條件下儲存2周。通過疏水相互作用色譜(HIC)檢測rhuMAb HER2的蛋氨酸氧化水平,并與5°C暗處保存2周的對照樣品的結果進行對比。
單抗-rHuPH20皮下注射劑與單抗靜脈注射劑配方的不同還在于前者加入了蔗糖/海藻糖/山梨醇(或增加了用量)。這三種輔料作為構象穩定劑,主要通過優先排斥機制穩定蛋白質。不同產品所用的輔料及濃度可能略有不同,那么蔗糖和海藻糖的穩定效果是否相似?海藻糖濃度的增加是否使蛋白質能夠更有效地承受相關的應力?最近與文章研究了不同的構象穩定性制劑組合物對曲妥珠單抗穩定性的影響[11]。該研究探討了不同制劑處方(含蔗糖、海藻糖或山梨醇)對曲妥珠單抗(trastuzumab)在凍融、凍干和機械振蕩等應力條件下穩定性的影響。結果顯示,所有處方中的曲妥珠單抗在構象穩定性(二級和三級結構)方面表現良好,但在聚集行為上存在差異。具體而言,含蔗糖的處方在凍干過程中易形成可溶性聚集體,而含山梨醇且不含表面活性劑的處方在機械振蕩后易產生不溶性聚集體。海藻糖的穩定效果與其濃度無關,表現出良好的全面穩定性。因此,在制劑處方設計中,若需避免凍干引起的聚集,應優先選擇海藻糖而非蔗糖;若處方中無表面活性劑,應避免使用山梨醇以防止機械應力下的不穩定性。總體而言,海藻糖因其穩定的表現和濃度無關的特性,是更優的選擇。
在單抗-rHuPH20皮下注射劑處方中,所有輔料都是傳統的,這些輔料已在已批準的抗體藥物中使用多年。到目前為止,幾十年來,FDA 批準的高濃度抗體產品中沒有使用任何新型輔料,主要是因為難以獲得 FDA 的批準。基于上述討論,對于開發單抗-rHuPH20皮下注射劑,構建一個基本包含組氨酸、蛋氨酸、海藻糖/蔗糖、聚山梨酯的平臺制劑是合理的,尤其是在早期階段,它可以加快研發時間表并提高制劑開發的工作效率。
艾偉拓作為藥用輔料供應商,始終聚焦高端制劑市場需求,致力于為中國制藥企業提供優質、安全的藥用輔料解決方案。為進一步加強行業交流與合作,艾偉拓特別搭建玻璃酸酶專業交流社群,旨在為產業鏈上下游伙伴打造資源共享、技術探討與業務協同的高效平臺。




 瀏覽器自帶分享功能也很好用哦~
瀏覽器自帶分享功能也很好用哦~




